从国内药品专利链接诉讼首案浅析药品专利链接制度
发布时间:2022-06-28
文 | 王函 王则周 汇业律师事务所
2022年4月15日,北京知识产权法院公开宣判中外制药株式会社诉温州海鹤药业有限公司确认是否落入专利权保护范围纠纷一案,该案是新《专利法》实施以来全国首例药品专利链接诉讼案件,也备受业内人士关注。本文就本案案情、案件焦点及案件启示等方面,进行介绍和分析。
一、案情简介
本案原告为中外制药株式会社(以下简称“原告”),其为上市专利药品“艾地骨化醇软胶囊”的上市许可持有人,也是该药品所涉及的专利号为ZL 2005800098777.6、发明名称为“ED-71制剂”的中国发明专利(以下简称“涉案专利”)的专利权人。该药品主要用来治疗骨质疏松。
2021年4月和2021年6月,国内两家案外人制药企业就涉案专利向国家知识产权局专利局(以下简称“专利局”)请求宣告专利无效。
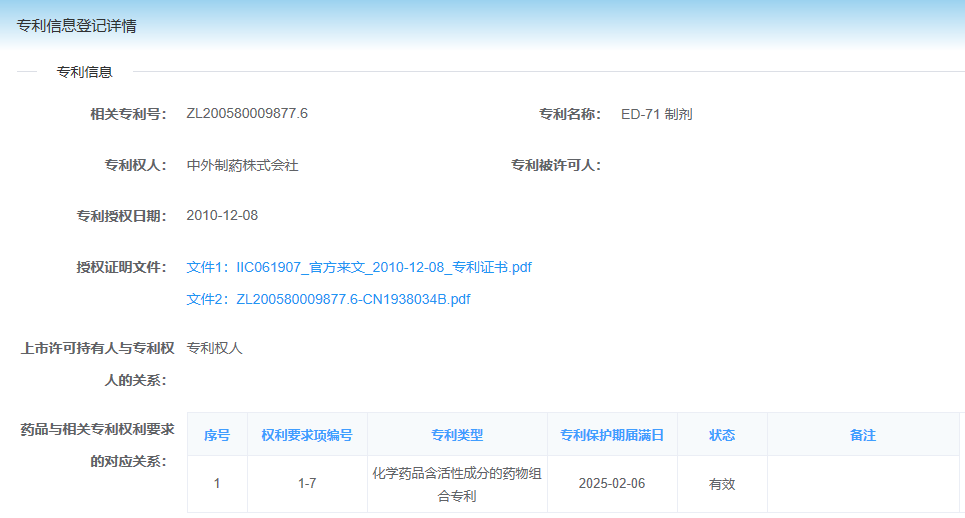
2021年7月,原告按《药品专利纠纷早期解决机制实施办法(试行)》(下称“《实施办法》”)的要求,将涉案专利相关信息登记到中国上市药品专利信息登记平台,登记的权利要求项编号1-7(如图1)。随后在无效宣告审理过程中,原告对权利要求进行了修改,由权1-7修改为权1-6。
(图1)
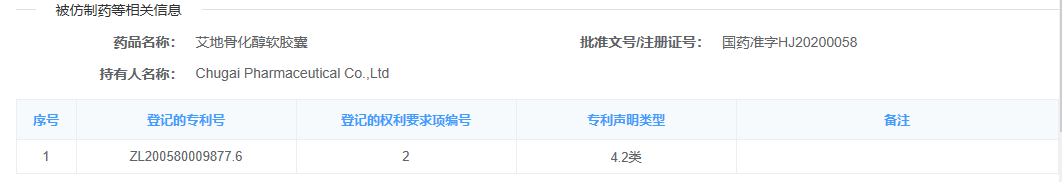
2021年8月,本案被告温州海鹤药业有限公司(以下简称“被告”)向国家药监部门申请了名称为“艾地骨化醇软胶囊”的仿制药上市许可申请,并就上述仿制药作出了第4.2类声明(如图2),即其仿制药未落入相关专利权保护范围。
(图2)
原告依据新《专利法》第七十六条规定向北京知识产权法院提起确认是否落入专利权保护范围之诉。法院于2021年11月受理。
专利局经审理后认为涉案专利不符合专利法中的创造性要求,并于2022年1月作出无效决定,宣布涉案专利专利权全部无效。但是否落入专利权保护范围纠纷一案并未因涉案专利权的全部无效而中止审理。
2022年4月15日,北京知识产权法院在涉案专利修改的基础上,作出被告申请注册的仿制药并未落入涉案专利权的保护范围,驳回原告诉讼请求的判决。
二、案件焦点
本案是新《专利法》实施以来全国首例药品专利链接诉讼案件,引发社会广泛关注,本案焦点即药品专利链接制度的落地。
药品专利链接制度,是一种在药品上市审评审批阶段,将申请注册的药品是否涉嫌专利侵权与其上市审批条件相链接的制度。药品专利链接制度的重要意义在于通过平衡原研药企业和仿制药企业利益,最大限度地推动药品可及性。2021年6月1日新《专利法》实施,其中第七十六条首次规定“药品专利链接制度”。同年7月,国家药品监督管理局、国家知识产权局联合发布《药品专利纠纷早期解决机制实施办法(试行)》(下称“《实施办法》”),规定了药品专利链接制度的具体实施方法。同时,中国上市药品专利信息登记平台正式上线。我国的药品专利链接制度初步形成。
《实施办法》第一条就指明了药品专利链接制度设立的目的是:“为了保护药品专利权人合法权益,鼓励新药研究和促进高水平仿制药发展”。之所以能达到这样的目的,底层逻辑在于:之前,仿制药在研发阶段,并不产生侵权,原研药企业无从介入也无法了解到仿制药的研发。如果仿制药上市后与原研药发生专利侵权纠纷,那么因为专利侵权案件较长的审理周期以及结果的不确定性,对于原研药企业来说,可能将面临高额的利益损失和诉讼成本。另一方面,对于仿制药企业而言,投入了大量的时间和精力研发出的仿制药如果被判侵权,也将面临巨额赔偿、禁止生产和销售等风险。而药品专利链接制度,在仿制药上市之前,为原研药企业和仿制药企业双方都提供了可预见性和确定性,避免在仿制药上市后给相关方造成实质性损害后再解决纠纷,解除双方的后顾之忧,因此既可以鼓励新药研究又可以促进仿制药的发展。
专利声明是药品专利链接制度的基础。按《实施办法》规定,仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明,并将声明及声明依据通知药品许可持有人。声明分为以下四类:

本案中,被告(仿制药申请人)就是进行了4.2类声明,原告(药品上市许可持有人)对被告的专利声明有异议,发起了诉讼。这是一个非常有代表性的案例。结合《实施办法》的规定和本案的流程,我们可以看到,一场典型的“确认是否落入专利权保护范围纠纷”,通常会包含以下五个阶段:
第一阶段:药品上市许可持有人,自行将专利相关信息登记到中国上市药品专利信息登记平台,作为仿制药上市申请时的比对基础。同时留下联系方式,以收取仿制药申请人的声明通知和有关材料。
第二阶段:仿制药申请人将相应声明及声明依据通知上市许可持有人,上市许可持有人非专利权人的,由上市许可持有人通知专利权人。
第三阶段:专利权人或利害关系人对专利声明有异议的(一般是针对第4类声明),在国家药品审评机构公开药品上市许可申请之日起45日内,向法院起诉,受理之日起15个工作日内将立案通知书副本提交国家药品审评机构,并通知仿制药申请人。
第四阶段:药品许可持有人(或专利权人)在国家药品审评机构公开药品上市许可申请之日起45日内不提起诉讼的,仿制药申请人可以提起诉讼,以确认其相关药品技术方案不落入相关专利权保护范围。
第五阶段:法院审理并作出判决。
需要特别指出的是,在我国的药品专利链接制度中,诉讼并不是唯一途径,而是开创性地采用了“双轨制”,即专利权人对4类专利声明有异议时,就申请上市药品的相关技术方案是否落入相关专利权保护范围,既可以向人民法院提起诉讼,也可以向国务院专利行政部门请求行政裁决。当事人对国务院专利行政部门作出的行政裁决不服的,还可以在收到行政裁决书后依法向人民法院起诉。
“双首”独占期的规定,是我国专利链接制度中另一个较有特色的规定。
相对于其他国家药品专利链接制度,体现了两大特点:其一,仿制药获得独占期的条件更为严苛,需要满足以下三个条件:1. 化学仿制药申请人提交4.1类声明;2. 根据其提出的宣告专利权无效请求,相关专利权被宣告无效;3. 据此首个获批上市的仿制药。其二,更丰厚的奖励:在12个月内不再批准其他相同品种的化学仿制药上市。
三、案件启示
笔者认为,本案的启示在于药品专利链接制度中专利登记、专利声明制度有待进一步优化,理由如下:
1. 目前药品专利链接制度解决的药品专利纠纷类型较少,存在局限性
目前在中国上市药品专利信息登记平台中登记的药品专利一般涉及药物活性成分化合物专利、含活性成分的药物组合物专利和医药用途专利。平台登记内容不包括:中间体、代谢产物、晶型、制备方法、检测方法等专利。可见,药品专利链接制度只解决部分药品专利纠纷,存在一定局限性。
2. 上市药品专利信息登记平台的功能和使用规则需要进一步优化
目前上市药品专利信息登记平台在首次登记或声明后,信息都没有修改更新的途径。具体而言,本案被告在信息登记平台声明中,“登记的权利要求项编号”一栏填写的是“2”(见图2),而根据《实施办法》的规定,仿制药企业需要对平台登记的所有权利要求进行声明,显然,仅仅对权利要求2声明是不符合要求的。同时,原告在无效宣告程序中,对权利要求书进行了修改,由权1-7修改为权1-6,也无法在登记平台中体现,容易造成混淆误导。
更为突出的一个问题是,如果专利已经被宣告无效,但是还在行政诉讼中,那么仿制药企业应当如何声明?是像本案被告这样,提交4类声明,还是提交2类声明?笔者从信息登记平台中查询到,仿制药企业针对涉案专利的声明五花八门,有被告这样声明4类的,也有3类的,甚至出现了1类声明,认为“登记的权利要求项编号”是“无”。所以如何界定“被宣告无效”?在专利权不稳定时,应当如何声明?等都需要有进一步的权威解释。但无论如何,笔者认为,增加信息登记平台登记人或者声明人的修改更新端口是非常有必要的。
3. 建议明确作出第4类声明的仿制药企未履行通知义务承担的后果及法律责任
根据《实施办法》第六条规定:声明未落入相关专利权保护范围的,声明依据应当包括仿制药技术方案与相关专利的相关权利要求对比表及相关技术资料。除纸质资料外,仿制药申请人还应当向上市许可持有人在中国上市药品专利信息登记平台登记的电子邮箱发送声明及声明依据,并留存相关记录。
同时,国家药监局关于实施《药品专利纠纷早期解决机制实施办法(试行)》相关事宜的通告(以下简称“通告”)中规定“申请人提交化学仿制药上市注册申请时,应当对照已在中国上市药品专利信息登记平台公开的相关药品专利信息,按实施办法要求提交专利声明,并将声明及声明依据通知上市许可持有人。未提交专利声明的,补正后方予以受理。”
从以上内容我们可以看出,如果进行第4类声明,仿制药企业具有两个法定义务,第一,自行通知上市许可持有人(通过上市许可持有人在登记平台公示的电子邮箱);第二,向上市许可持有人提供声明依据,也就是仿制药技术方案与相关专利的相关权利要求对比表及相关技术资料。但是《实施办法》并未规定,如果仿制药企业没有尽到通知义务,应该承担怎样的法律责任。这也是本案中,原告提出的争议焦点之一。从原告的表述来看,被告可能并未在规定期限内按法律规定提交与上市药品专利的对比及相关技术资料。从判决结果来看,被告似乎也没有因为未在法定期限内提交相关资料而承担不利后果。再结合国家药监局《通告》中的规定,我们大概可以推测案件的进程是这样的:原告收到被告泛泛的声明通知,但并未收到声明依据→因为没有收到声明依据,无法判断仿制药是否落入涉案专利的保护范围,只能向法院寻求救济→法院受理后要求被告补正声明依据→法院审理并作出判决。
笔者认为针对4类声明及其告知义务的规定,相关法律法规有进一步具体化的空间和必要。在美国药品专利链接制度中,原研药企业和仿制药企业之间的和解支付是化解专利纠纷的重要途径之一。而和解的基础是建立在原研药企业和仿制药企业互相了解对方技术信息之上。如果进一步明确和监督仿制药企业声明及告知义务,将更有利于保障原研药企业的合法权益,同时,也将提高专利纠纷在诉讼前和解的可能,节约司法资源。
四、对药企的建议
随着我国药品专利链接制度的建立,以及上市药品专利信息登记平台上线,对于原研药企业而言,应当及时在登记平台上进行专利登记。如果专利登记的时间晚于仿制药企业1类声明的受理日期,那么原研药企业将有可能丧失启动药品专利链接制度的权利,失去将专利纠纷化解在前期的机会。同时,应当更加注重专利监控,及时发现针对自身药品专利的声明,根据不同的声明类型作出相应的应对,避免错过异议时限。在专利布局中,力求围绕药品获得更多的专利,增加仿制药企业的专利挑战难度。
对于仿制药企业而言,需要更加注重专利分析。通过自身技术与登记的药品专利进行对比分析,制定合理的研发策略,进而选择最适当的声明类型,可以保证自身利益的最大化。针对哪些专利可以利用1类声明抢占先机?主张专利权应被宣告无效作出4.1类声明还是主张仿制药未落入专利保护范围作出4.2类声明?是否挑战市场独占期奖励机制?这些都离不开对专利的精准分析。
五、结语
我国的药品专利链接制度,作为一个落地不久的新生制度,虽然在初期运行中出现了一些问题和有待完善的地方。但是无疑将对新药研究和高水平仿制药发展起到积极的促进作用。面对这个崭新而复杂的制度,无论原研药企业还是仿制药企业,都需要将该部分内容作为企业知识产权合规管理体系中的重要一环,深入做好相关研究和准备工作。








